Pracownia Przetwarzania i Analizy Obrazów Mikroskopowych
dr hab. Anna Korzyńska, profesor IBIB - Kierownik Pracowni
prof. dr hab. Włodzimierz Klonowski ✞
mgr inż. Łukasz Roszkowiak
mgr inż. Jakub Żak
lek. med. Krzysztof Siemion
W badaniach naukowych w Pracowni korzystamy z metod analizy procesów obserwowanych/monitorowanych na mikroskopowych obrazach i ich sekwencjach dokumentujących tkanki oraz procesy życiowe komórek.
Badania są skoncentrowane na ściśle powiązanych celach:
- na rozwoju metod przetwarzania i analizy mikroskopowych obrazów barwionych cienkich skrawków tkanek i żywych komórek,
- na opracowaniu wspomagania metod diagnostycznych, terapeutycznych i badań naukowych za pomocą ilościowej analizy morfologii i zachowania indywidualnych komórek oraz ich populacji,
oraz
- na liniowej i nieliniowej analizie sygnałów oraz obrazów.
Wspomaganie mikroskopii optycznej za pomocą ilościowych metod analizy obrazów umożliwia uchwycenie zależności pomiędzy zjawiskami biologicznymi, np.: (1). pomiędzy morfologią, a zachowaniem komórek (hepatocytów i fibroblastów bez i ze zmianami genetycznymi [Korzyńska i wsp., 2017]) oraz (2) warunkami efektywnego namnażania komórek w kulturach komórkowych, (neuralnych komórek macierzystych [Korzyńska, 2007; Korzyńska i wsp., 2008]).
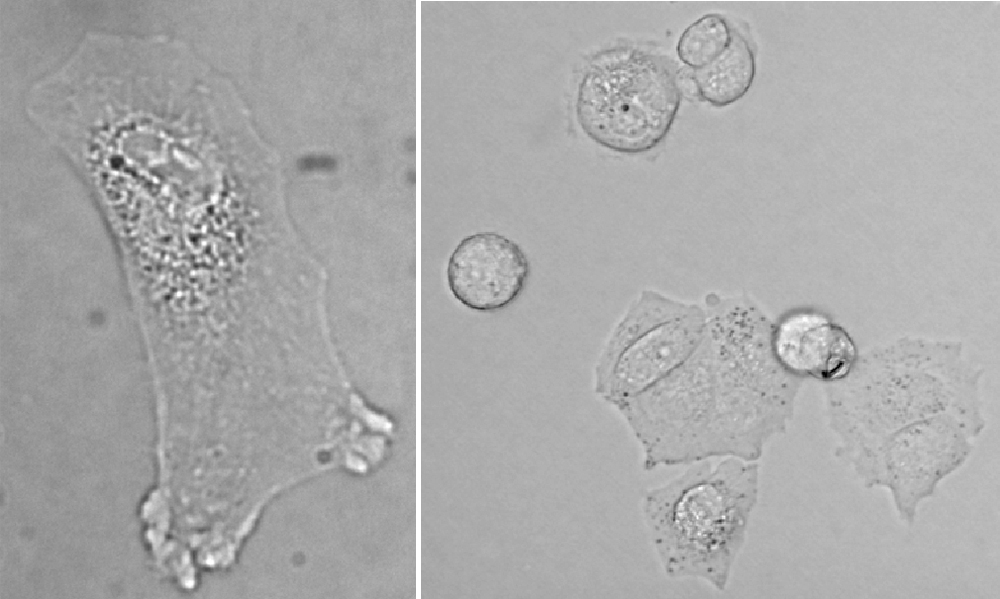
Rys. 1. Obrazy komórek obserwowanych w jasnym polu: lewy - fibroblast izolowany z skóry człowieka i prawy – neuralne komórki macierzyste linii HUCB−NSC w hodowli.
Analiza obrazów mikroskopowych tkanek barwionych w celach diagnostycznych i prognostycznych, ze wspomaganiem tego procesu za pomocą metod analizy obrazów, jest już od dawne wcielana w życie, ale wciąż nie daje zadowalających rezultatów. Wydaje się, że w dobie cyfryzacji służby zdrowia, kiedy preparaty na szkiełkach mają być zastąpione ich cyfrowymi wersjami, zwanymi wirtualnymi slajdami, lokalne cechy preparatu mogą i powinny być oceniane automatycznie przy pomocy metod analizy obrazów. W Pracowni zaproponowano ilościowe metody analizy jąder komórkowych, widocznych na obrazach cienkich skrawków tkanek pobranych w biopsji i barwionych immunohistochemicznie z użyciem DAB i hematoksyliny. Jak widać na przedstawionym przeglądzie preparatów, charakterystyka obrazów w różnych chorobach (w chłoniakach, oponiakach i raku sutka) i dla różnych przeciwciał (FoxP3, Ki67), a nawet dla różnych organów objętych tą samą chorobą (skóra i migdałki w DLBCL) jest bardzo różna i dlatego wymaga specjalizowanych metod, uwzględniających specyfikę architektury tkanki i jej zmian chorobowych.
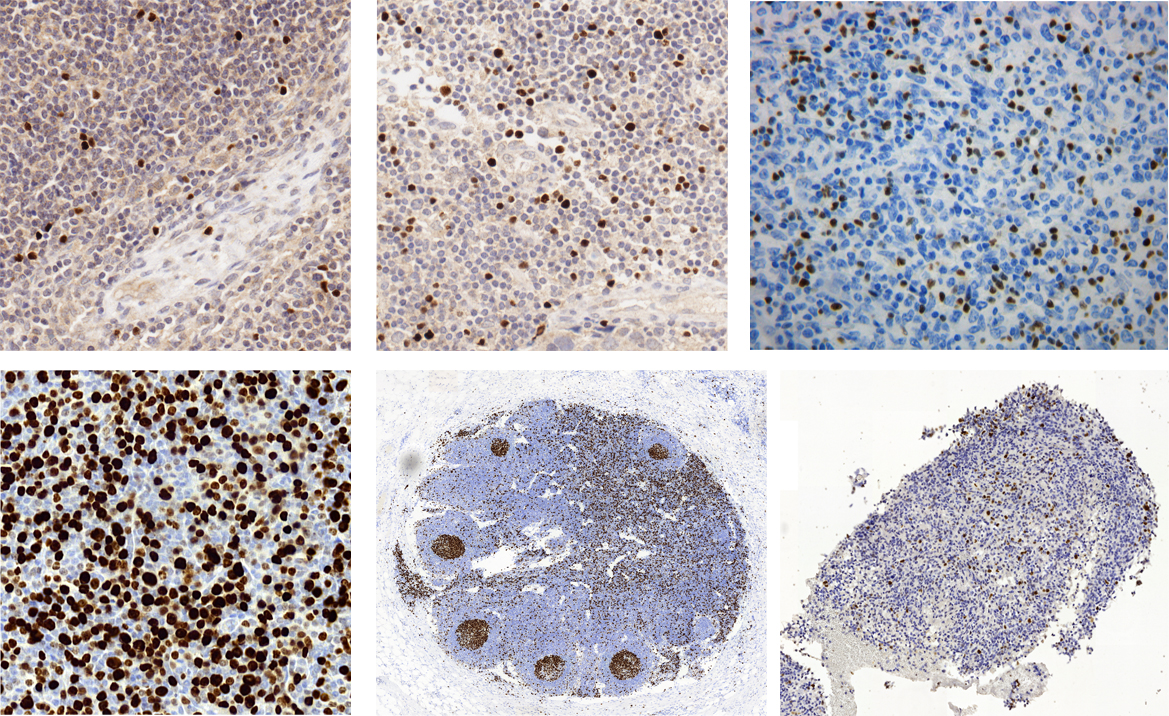
Rys. 2a. Obrazy fragmentów preparatów barwionych immunohistochemicznie z użyciem DAB&H:
- w górnym wierszu - obrazy barwione markerem przeciw FoxP3, wskazującym jądra komórek T-regulatorowych w następujących tkankach (od prawej): sutek w raku sutka, węzeł limfatyczny po przerzutach, węzeł limfatyczny w chłoniaku rozlanym i
- w dolnym wierszu - obrazy barwione przeciw markerowi Ki67 (marker proliferacji) w następujących tkankach (od prawej): skóra w rozlanym chłoniaku z dużych komórek B (ang. DLBCL), zdrowy węzeł limfatyczny, mózg w przebiegu oponiaka. (ang. meningoma)
W niektórych chorobach diagnozę stawia się na podstawie oszacowania liczby specyficznych komórek, uwidocznionych przez zastosowanie barwienia tkanek (np. eozyną i hematoksyliną lub barwienie immunohistochemiczne) oraz na postawie oceny ich architektury tkankowej.
Spośród opisanych w literaturze metod segmentacji obrazów tkanek barwionych, żadna nie jest uniwersalna i nie da się przy jej pomocy dowolnie podzielić obrazu na segmenty zawierające obiekty immunopozytywne (brązowe jądra komórkowe na prezentowanych obrazach) i immunonegatywne (niebieskie jądra komórkowe), zgodnie z percepcją specjalisty patologa. Dlatego w Pracowni są rozwijane poniżej omówione nowe metody segmentacji i udoskonalane już istniejące [Korzyńska i Zduńczuk, 2008] na drodze dostosowywania ich działania do wykorzystania charakterystycznych własności poszczególnych technik mikroskopowych [Korzyńska i Iwanowski 2008; Iwanowski i wsp., 2009] oraz wiedzy o obserwowanych komórkach i tkankach [Iwanowski i wsp., 2010, Callau i wsp., 2014].
Ponadto preparty tkankowe mogą być analizowane na podstawie biopsji tkanek stanowiących ich cienkie skrawki pochdzące od pacjenta lub jako macierze tkanek pochodzące od różnych pacjentów i barwionych w jednych warunkach. Niezależnie od sposobu przygotowania preparaty zawierają zarówno fragmenty istotne jaki i nieistotne lub wręcz stanowiące artefakty, które należy oddzielić od fragmentów nadajacych się do analizy ilościowej.
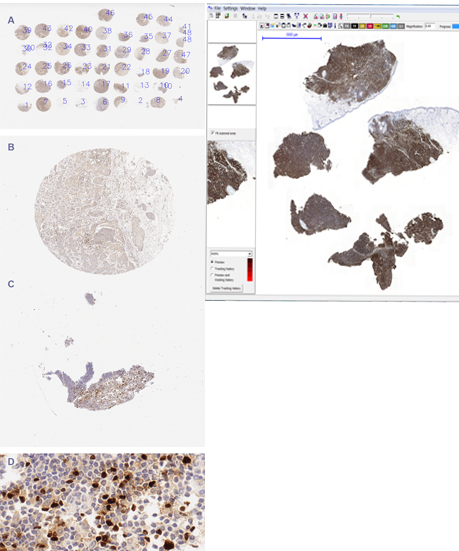
Rys. 2b. TMA i WSI
Dorobkiem Pracowni jest zaproponowanie następujących algorytmów do wykrywania i zliczania jąder komórkowych z pozytywną immunoreaktywnością, czyli zabarwionych na brązowo:
- Metoda powstała w ramach współpracy z Molecular Biology and Research Section of the Hospital de Tortosa Verge de la Cinta i z Pathology Department Hospital de Tortosa Verge de la Cinta, finansowana przez European Cooperation in Science and Technology (COST) Action, a dokładniej przez Telepathology Network in Europe 2007-2011 (EURO-TELEPATH) o symbolu IC0604 i tytule „Prospectives on Digital Pathology”, opublikowana w 2010 [Korzynska i wsp., 2010, Korzynska i wsp., 2013]. Metoda jest przeznaczona do analizy komórek znakowanych przeciwciałem FOXP3 w preparatach pacjentów z chłoniakami rozlanymi (ang. Follicular Lymphoma);
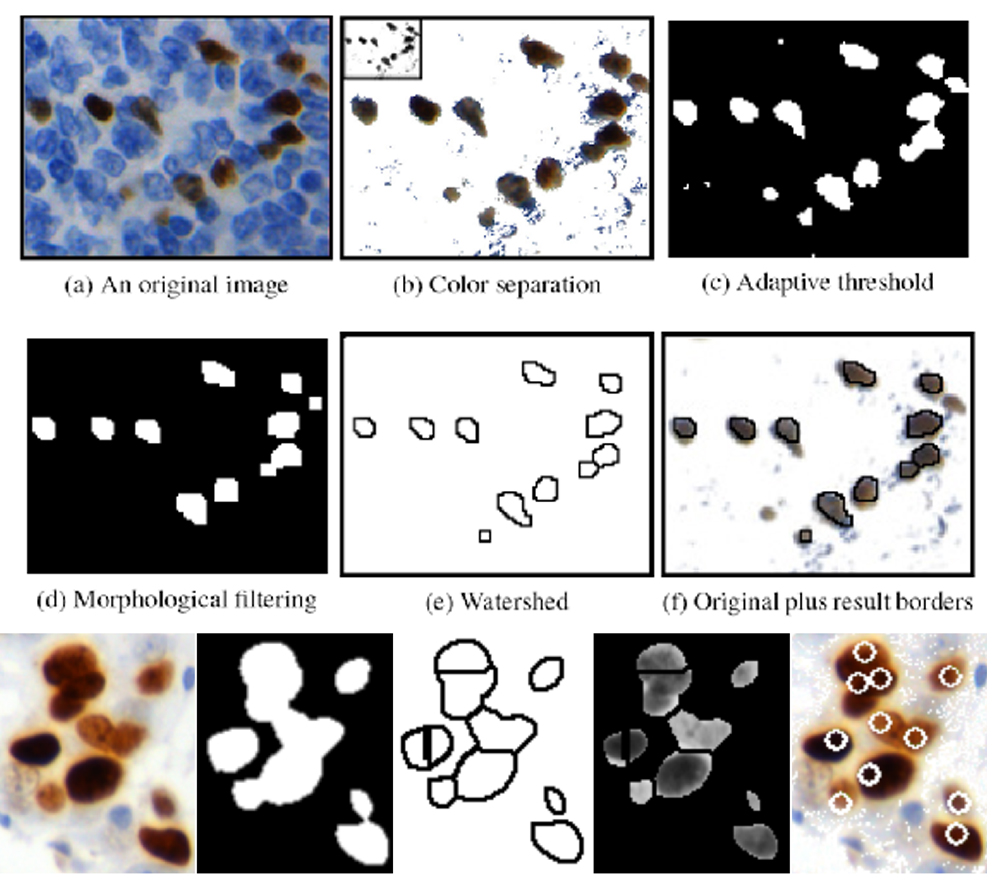
Rys. 3. Metoda zliczania ilości immunioreaktywnych jąder komórkowych oparta na separacji koloru,
progowaniu adaptacyjnym i wododziale
- Metoda METINUS [Roszkowiak i wsp., 2015a, Roszkowiak i wsp., 2015b, Roszkowiak i wsp., 2016], powstała w ramach realizacji współpracy z tym samym ośrodkiem w roku 2014, a jej modyfikacja z 2015, zwana METINUS Plus, [Korzynska i wsp., 2017] została opracowana na potrzeby projektu pt.: „Rozwój zautomatyzowanych metod ilościowego oznaczania markerów immunohistochemicznych do określenia wzorców odpowiedzi immunologicznej w raku sutka” i dotyczy analizy liczby limfocytów T-regulatorowych w preparatach pacjentek z rakiem sutka w dwóch grupach – (1) z lub (2) bez przerzutów do węzłów chłonnych.

Rys. 4. Metody Metinus i MetinusPlus: wykorzystujące parametry rozkładu jasnści jąder immunoraktywnych
i zmodyfikowaną wersję wododziału przedstawioną na schemacie po prawej stronie
- Metody MetPiKi67 z 2015 roku [plakat] na potrzeby projektu „Platforma internetowa komputerowej analizy obrazów mikroskopowych do wspomagania współczesnej diagnostyki patomorfologicznej” oraz jej modyfikacja MetPiKi67bis z 2017, wykonana w temacie statutowym [jeszcze nieopublikowana] pozwalają zanalizować obrazy barwionych skrawków tkanek od chorych z chłoniakami typu DLBCL (ang. Diffuse Large B Cell Lymphoma). W przypadku tej metody analiza ilościowa dotyczy zarówno jąder komórek immunoreaktywnych (brązowych) jak i komórek immunonedatywnych (niebieskich).

Rys. 5. Rezultaty działania metody MetPiKI67
Wszystkie metody posłużyły współpracującym z nami lekarzom do przeprowadzenia badań nad określeniem wzorca odpowiedzi immunologicznej w raku sutka [López i wsp., 2014; Callau i wsp., 2014] oraz nad analizą mikrośrodowiska potrójnie negatywnego raka sutka, który nie wykazuje pełnej odpowiedzi na chemioterapię [Lejeune i wsp., 2013].
Poza tym, na potrzeby analizy struktur histologicznych i preparatów cytologicznych, przebadaliśmy problemy standaryzacji [Korzyńska i wsp., 2010] i oceny jakości obrazu oraz zaproponowaliśmy metodę korekcji koloru na podstawie wczytania szkiełka kalibracyjnego [Korzynska i wsp., 2016, Markiewicz i wsp., 2016].

Rys. 6. Schemat korekcji koloru bazyjący na specjanie przygotowanych szkiwłkach kalibracyjnych
Zaproponowano również metodę i oprogramowanie do dzielenia obrazu wielkoobszarowego, przedstawiającego tzw. mikromacierz (ang. TMA), czyli obraz próbek wielu pacjentów zebrany na szkiełku i wspólnie barwiony. Zaproponowane oprogramowanie pozwala podzielić wielkoobszarowy obraz na poszczególne próbki i opisać je zgodnie ze schematem [Roszkowiak i wsp., 2016].
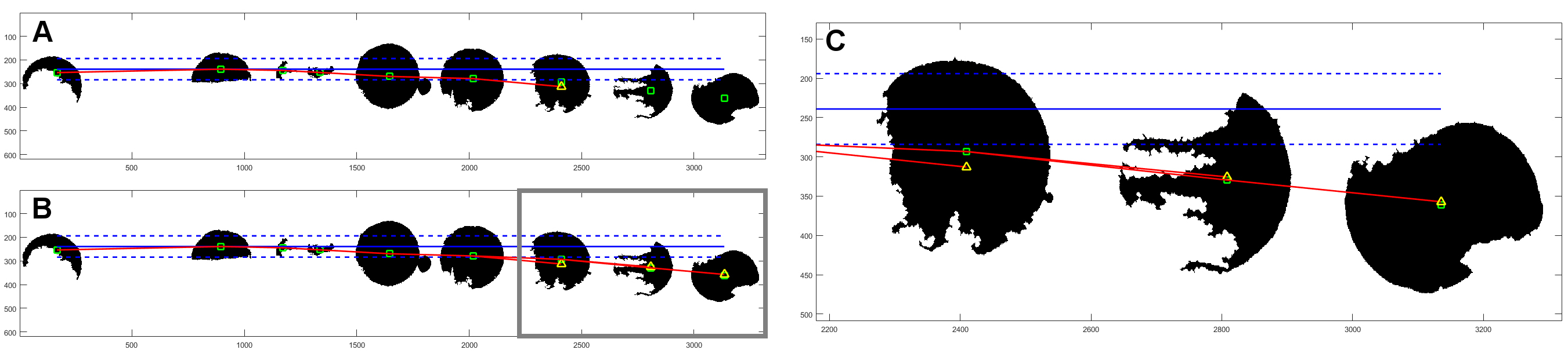
Rys. 7. Schemat działania metody PATMA
W celu oceny jakości proponowanych metod analizy ilościowej i segmentacji przygotowano narzędzia do tworzenia syntetycznych obrazów mikroskopowych o wymaganych parametrach [Iwanowski i wsp., 2009, Iwanowski i wsp., 2015a, Korzynska i wsp., 2013]. Oprogramowanie oparto na rozbudowie metody SIMPl, zaproponowanej przez Lechmusollę i współpracowników [Lehmussola i wsp., Computational framework for simulating fluorescence microscope images with cell populations. Med Imaging, IEEE Trans. 2007, 26 (7): 1010-1016 i [Lehmussola i wsp., Synthetic images of high-throughput microscopy for validation of image analysis methods. Proc IEEE. 2008, 96 (8): 1348-1360].
W Pracowni zrealizowano projekty:
- „Opracowanie metody segmentacji obrazów komórkowych na podstawie sekwencji obrazów mikroskopowych”, finansowany przez Ministerstwo Nauki i Szkolnictwa Wyższego RP nr NN518391134, kierowany przez dr Annę Korzyńską (10.08.2008 do 09.06.2011)
- „Rozwój zautomatyzowanych metod ilościowego oznaczania markerów immunohistochemicznych do określenia wzorców odpowiedzi immunologicznej w raku sutka”; projekt finansowany przez Institute of Health Carlos III w Hiszpanii i realizowany przez Molecular Biology and Research Section, Szpitala Verge de la Cinta w Tortozie, kierowany przez dr Carlosa Lopeza (1.01.2013 r. do 31.06.2016 r.)
- „Zautomatyzowana analiza mikrośrodowiska potrójnie negatywnego raka sutka, który nie wykazuje pełnej odpowiedzi na chemioterapię. Poszukiwanie wskaźników wznowy”; projekt finansowany przez Institute of Health Carlos III w Hiszpanii i realizowany przez Molecular Biology and Research Section, Szpitala Verge de la Cinta w Tortozie, kierowany przez dr Merylene Lejeune (1.01.2014 r. do 31.12.2016 r.)
- „Platforma internetowa komputerowej analizy obrazów mikroskopowych do wspomagania współczesnej diagnostyki patomorfologicznej” (akronim PIKAOM); projekt finansowany przez NCBiR jest wykonywany we współpracy z Wojskowym Instytutem Medycznym i Politechniką Warszawską, kierowany przez dr hab. Tomasza Markiewicza, prof. nadzw. (27.09.2013 do 30.10.2016)
Natomiast projekt pt.: ”Narzędzie wspomagania histopatologa w analizie wirtualnych slajdów tkanek pacjentów z rakiem sutka barwionych immunohistochemicznie z użyciem DAB&Hematoksyliny”, finansowany przez NCN, kierowany przez Łukasza Roszkowiaka, jest realizowany od 11.09.2014 - w realizacji.
Wyposażenie
W laboratorium wykorzystuje się mikroskop optyczny, pracujący w technice jasnego pola lub fluorescencji, z możliwością cyfrowego zapisu poklatkowego sekwencji obrazowych, ze sterowanymi z komputera przesłonami (do światła UV i do światła konwencjonalnego) i ze stolikiem mikroskopu (w zakresie osi Z mikroskopu).
Sława kluczowe: analiza obrazów, segmentacja obrazów, obrazy mikroskopowe, rejestracja poklatkowa, zachowania komórek, ruch komórek, analiza cyfrowych wielkoobszarowych obrazów, korekcja i standaryzacja skanowanych obrazów barwionych tkanek, patologia cyfrowa, wspomagana komputerowo morfometria ilościowa.
MENU
- Aktualności
- O Instytucie
- Misja i Władze
- HR Excellence
- Studia doktoranckie
- Szkoły doktorskie
- Stopnie naukowe
- Działalność naukowa
- Oferta Instytutu
- MCB
- Wydawnictwa
- Biblioteka
- Centrum Konferencyjne
- Użyteczne linki
- Pracownicy
- Galeria
- Dla mediów
- Kontakt
- Pomoc
- Polityka prywatności
Instytut Biocybernetyki i Inżynierii Biomedycznej im. Macieja Nałęcza PAN, ul. Ks. Trojdena 4, 02-109 Warszawa
E-mail:Ten adres pocztowy jest chroniony przed spamowaniem. Aby go zobaczyć, konieczne jest włączenie w przeglądarce obsługi JavaScript.; Telefon: (+48) 22 592 59 00;
Copyright(c) 2016 IBIB PAN
Wszelkie prawa zastrzeżone
W celu zapewnienia jak najlepszych usług online, ta strona korzysta z plików cookies. Usuń ciasteczka
W celu zapewnienia jak najlepszych usług online, ta strona korzysta z plików cookies.
Jeśli korzystasz z naszej strony internetowej, wyrażasz zgodę na używanie naszych plików cookies. Dalsze informacje
Użyteczne linki
POLITYKA PRYWATNOŚCI
INFORMACJA O PRZETWARZANIU DANYCH OSOBOWYCH
OGÓLNE
Komitet Biocybernetyki i Inżynierii Biomedycznej Polskiej Akademii Nauk
Polskie Towarzystwo Inżynierii Biomedycznej
Ministerstwo Nauki i Szkolnictwa Wyższego
Biuletyn Informacji Publicznej
WSPIERANIE DZIAŁALNOŚCI NAUKOWEJ
Fundacja na rzecz Nauki Polskiej (FNP)
Narodowe Centrum Badań i Rozwoju (NCBiR)
Agencja Badań Medycznych (ABM)
Narodowa Agencja Wymiany Akademickiej (NAWA)
Polska Agencja Rozwoju Przedsiębiorczości (PARP)
PROGRAMY RAMOWE UNII EUROPEJSKIEJ
BAZA PUBLIKACJI
Lista czasopism punktowanych MNiSW
InCites Journal Citation Reports
ISI Web of Knowledge Journal Citation Report
ICM - Wirtualna Biblioteka Nauki
INNE
ZBIORY DANYCH




















